化學性質
腐蝕性
純硫酸加熱至290℃分解放出部分三氧化硫,直至酸的濃度降到98.3%為止,這時硫酸為恒沸溶液,沸點為338°C。無水硫酸體現酸性是給出質子的能力,純硫酸仍然具有很強的酸性,98%硫酸與純硫酸的酸性基本上沒有差別,而溶解
三氧化硫的發煙硫酸是一種超酸體系,酸性強于純硫酸,但是廣泛存在一種誤區,即稀硫酸的酸性強于濃硫酸,這種想法是錯誤的。的確,稀硫酸第一步
電離完全,產生大量的
水合氫離子H
3O
+;但是濃硫酸和水一樣,自身自偶電離會產生一部分硫酸合氫離子H
3SO
4+,正是這一部分硫酸合質子,導致純硫酸具有非常強的酸性,雖然少,但是酸性卻要比水合質子強得多,所以純硫酸的
哈米特酸度函數高達-12.0。
在硫酸
溶劑體系中,H
3SO
4+經常起酸的作用,能質子化很多
物質產生離子型
化合物:
NaCl+ H
2SO
4==NaHSO
4+HCl(不加熱都能很快反應)
KNO
3+ H
2SO
4→K
++HSO
4-+HNO
3
HNO
3+ H
2SO
4→NO
2++H
3O
++2HSO
4-
CH
3COOH+ H
2SO
4→CH
3C(OH)
2++HSO
4-
HSO
3F+ H
2SO
4→H
3SO
4++SO
3F
-(
氟磺酸酸性更強)
上述與HNO
3的反應所產生的NO
2+,有助于
芳香烴的硝化反應。
濃硫酸特性
1.脫水性
脫水指濃硫酸脫去非游離態水分子或按照水的氫氧原子組成比脫去有機物中氫氧元素的過程。就硫酸而言,
脫水性是濃硫酸的性質,而非稀硫酸的性質,濃硫酸有脫水性且脫水性很強,脫水時按水的組成比脫去。物質被濃硫酸脫水的過程是
化學變化,反應時,濃硫酸按水分子中氫氧原數的比(2:1)奪取被脫水物中的氫原子和氧原子或脫去非游離態的結晶水,如
五水硫酸銅(CuSO
4·5H
2O)。

濃硫酸迅速蝕穿毛巾
可被濃硫酸脫水的物質一般為含
氫、
氧元素的有機物,其中
蔗糖、木屑、紙屑和
棉花等物質中的
有機物,被脫水后生成了黑色的
炭,這種過程稱作
炭化。一個典型的炭化現象是蔗糖的黑面包反應。在200mL燒杯中放入20g
蔗糖,加入幾滴水,水加適量,攪拌均勻。然后再加入15mL質量分數為98%的濃硫酸,迅速攪拌。觀察實驗現象。可以看到
蔗糖逐漸變黑,體積膨脹,形成疏松多孔的海綿狀的炭,反應放熱,還能聞到刺激性氣體。
C12H22O11==濃硫酸==12C+11H2O
同時進行碳與濃硫酸反應:
C+2H2SO4(濃)==加熱==CO2↑+2SO2↑+2H2O
2.強氧化性
(1)與金屬反應
①常溫下濃硫酸能使鐵、鋁等金屬
鈍化。②加熱時,濃硫酸可以與除金、鉑之外的所有金屬反應,生成高價金屬硫酸鹽,本身一般被還原成
二氧化硫。
Cu+2H
2SO
4(濃)==
加熱==CuSO
4+SO
2↑+2H
2O
2Fe+6H
2SO
4(濃)==
加熱==Fe
2(SO
4)
3+3SO
2↑+6H
2O
在上述反應中,硫酸表現出了強氧化性和酸性。
(2)與非金屬反應
熱的濃硫酸可將
碳、
硫、
磷等非金屬單質氧化到其高價態的
氧化物或
含氧酸,本身被還原為
二氧化硫。在這類反應中,濃硫酸只表現出
氧化性。
C+2H
2SO
4(濃)=
加熱=CO
2↑+2SO
2↑+2H
2O
S+H
2SO
4(濃)==
加熱==3SO
2↑+2H
2O
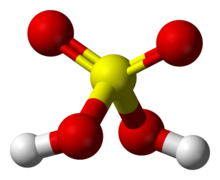
硫酸分子的球棍模型
2P+5H2SO4(濃)==加熱==2H3PO4+5SO2↑+2H2O
(3)與其他還原性物質反應
濃硫酸具有強氧化性,實驗室制取
硫化氫、
溴化氫、
碘化氫等還原性氣體不能選用濃硫酸。
H
2S+H
2SO
4(濃)==S↓+SO
2↑+2H
2O
2HBr+H
2SO
4(濃)==Br
2↑+SO
2↑+2H
2O
2HI+H
2SO
4(濃)==I
2↓+SO
2↑+2H
2O
稀硫酸特性
性質
-
可與多數金屬(比銅活潑)和絕大多數金屬氧化物反應,生成相應的硫酸鹽和水;
-
可與所含酸根離子對應酸酸性比硫酸根離子弱的鹽反應,生成相應的
硫酸鹽和弱酸;
-
-
可與氫前金屬在一定條件下反應,生成相應的硫酸鹽和
氫氣;
-
-
檢驗
檢驗方法:使用經過鹽酸(HCl)酸化的的
氯化鋇(BaCl
2)。向待測物溶液滴入幾滴經過鹽酸酸化的氯化鋇溶液,震蕩,如果產生白色沉淀;向溶液中加入鎂粉后生成可燃性氣體,則待測溶液中含有硫酸。但此方法僅限中學階段。
常見誤區
稀硫酸在中學階段,一般當成H2SO4=2H++SO42-,兩次完全電離,其實不是這樣的。根據硫酸酸度系數pKa1=-3.00,pKa2=1.99,其二級電離不夠充分,在稀硫酸中HSO4-=可逆=H++SO42-,并未完全電離,1mol/L的硫酸一級電離完全,二級電離約電離10%,也就是溶液中仍存在大量的HSO4-。而即使是NaHSO4溶液0.1mol/L時,硫酸氫根也只電離了約30%

